Етери и епоксиди (епокиси)
Номенклатура:
Eтери се наричат производните на водата (Н-О-Н), в която водородните атоми са заместени с въглеводородни остатъци (алкилови, арилови и др.). Те съдържат етерна връзка (С–О–С). Етерите биват мастни (R–O–R), аро-матни (Ar–O–Ar) или смесени мастно-ароматни (R–O–Ar). Типичен мастен етер е диетиловият (леснолетлива течност, отличен разтворител), а дифе-нилетерът (кристално вещество) е най-простият ароматен етер. Представ-ките за групите RO- и ArO- съгласно правилата на заместителната номенк-латура на IUPAC са съответно алкилокси- (съкр. алкокси-) и арилокси-, а по радикало-функционалната номенклатура се изброяват радикалите по азбучен ред и се добавя думата “етер”.
Заместителна Радикало-функционална
CH3OCH3 метоксиметан (ди)метил(ов) етер
CH3CH2OCH2CH3 етоксиетан (ди)етил(ов) етер
CH3(CH2)2CH2OCH3 1-метоксибутан бутилметил(ов) етер
C6H5OCH2CH3 етоксибензен етилфенил(ов) етер
C6H5OC6H5 феноксибензен (ди)фенил(ов) етер
При епоксидите: с локанти се означават въглеродните атоми, свързани чрез кислороден мост “–О–“, и се използва представката епокси-. Друг ва-риант е да се разглеждат като производни на оксирана (кислородният атом в този случай носи № 1). Тривиалните названия “етиленов окис (оксид)” и “пропиленов окис (оксид)” все още се използуват в индустрията. Ето някои примери:


Получаване:
1. От алкални алкоксиди и халогенопроизводни чрез нуклеофилно замест-ване (метод на Уилямсън, Лондон, 1850):


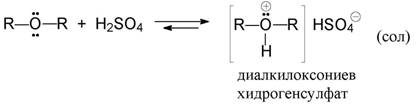
2. Дехидратация на две молекули алкохол - по механизъм реакцията е съ-що нуклеофилно заместване. Получават се само симетрични етери (R1=R2):
2ROH -----------------> R—O—R + H2O
Механизъм:
Първоначално се образува кисел естер на сярната киселина (алкилхидро-
генсулфат):
+ Н2O
В следващия стадий втора молекула алкохол (нуклеофил!) замества добра-та напускаща група -OSO3H
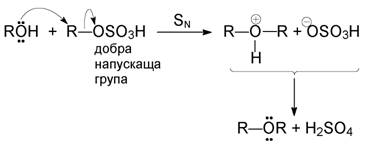
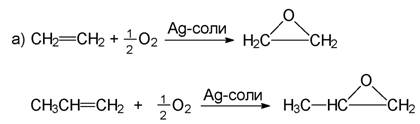
3. Епоксиди (епокиси). Получават се чрез каталитично окисление на алкени (промишлен метод) или чрез по-универсалната реакция на Н. А. Приле-жаев (Варшава, 1909 г.) с помощта на пероксикиселини:
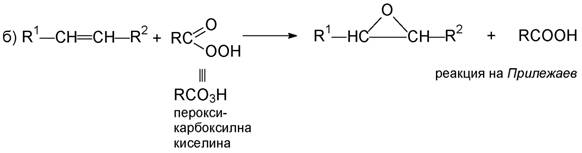
Механизъм: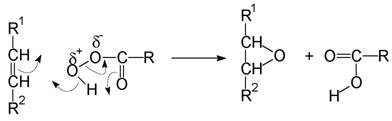
Едно доказателство за този синхронен механизъм е фактът, че епоксидира-нето протича стереоспецифично:
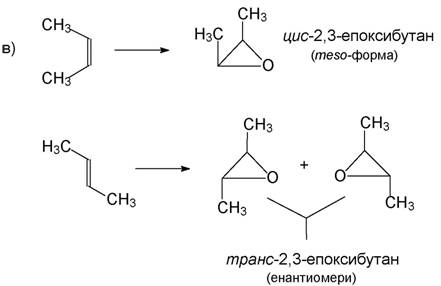
г) 1,2-Епоксиди (оксирани) се получават също и чрез елиминиране на хало-геноводород от β-халогеноалкохоли с помощта на алкална основа (изразете самостоятелно уравнението и механизма на тази реакция!).
Химични свойства
1. Основност. Етерите проявяват слаби основни свойства, поради което разтварят някои силни киселини при обикновена температура. Разтвор на хлороводород в безводен етер се използува често като “безводна солна ки-селина” (Еt2O.HCl = етер-хлороводород).
2. Разпадане на етери с халогеноводородни киселини. При ароматните етери винаги се разкъсва връзката алкил-кислород, а не арил-кислород (защо?). Първоначално обратимо се образува сол, чийто анион е добър нуклеофил и при нагряване се извършва нуклеофилно заместване:
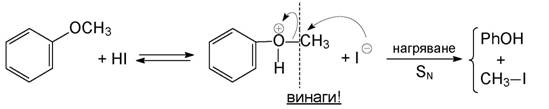
Най-подходяща за тази цел е йодоводородната киселина, защото тя е най-силната халогеноводородна киселина и защото йодидният йон е най-добър нуклеофил. При несиметричните мастни етери се получава смес от два ал-кохола и две халогенопроизводни (изразете реакционната схема!).
3. Образуване на пероксиди чрез автоокисление (от кислорода на въздуха):
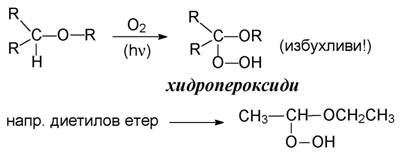
Поради опасността от експлозия етери никога не се дестилират до сухо и винаги се използува водна или маслена баня за нагряване на дестилацион-ния съд.
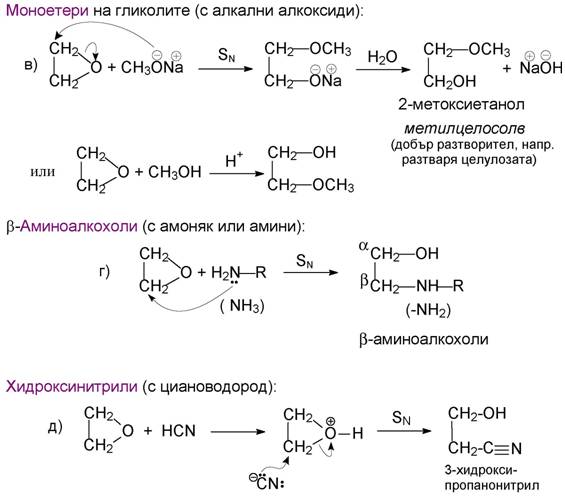
4. Реакции на епоксиди. Най-често тези реакции протичат като присъеди-няване с отваряне на нестабилния триатомен оксиранов пръстен (по меха-низъм е вътрешномолекулно нуклеофилно заместване). Протоновите кисе-лини катализират тези превръщания, тъй като епоксидите също имат слабо базични свойства. Получават се различни производни на алкохолите – гли-коли (двувалентни алкохоли), халогенохидрини, моноетери на гликолите, аминоалкохоли и др. Следните примери са добра илюстрация:
Гликоли (чрез киселинна или алкална хидролиза):
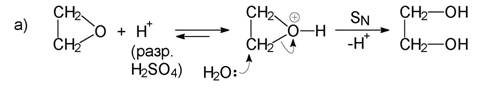
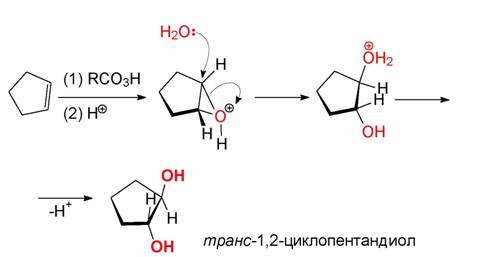
Хлорохидрини (чрез присъединяване на халогеноводород): По правило тези присъединителни реакции протичат анти-диаксиално, т. е. ако се тръгне например от циклоалкен, се получават транс-диоли: 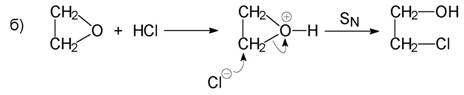



 Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!
Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!
Коментари